Điện Phân
Ôn tập kiến thức về điện phân
Câu 1: Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình oxi hóa là
Câu 2: Kí hiệu cặp oxi hoá – khử ứng với quá trình khử: Fe²⁺ + 2e ⇌ Fe là
Câu 3: Ở điều kiện chuẩn, thiết lập được điện cực copper (Cu) bằng cách nhúng thanh Cu vào dung dịch
Câu 4: Ở điều kiện chuẩn, thiết lập được điện cực silver (Ag) bằng cách nhúng thanh Ag vào dung dịch
Câu 5: Đối với điện cực hydrogen chuẩn, áp suất khí hydrogen được hấp phụ trên lá Pt và nồng độ ion H⁺ trong dung dịch chất điện li lần lượt là
Câu 6: Giá trị thế điện cực chuẩn của cặp oxi hoá – khử nào được quy ước bằng 0 V?
Câu 7: Cho thế điện cực chuẩn của các cặp oxi hoá – khử: Fe²⁺/Fe=-0,44 V, Na⁺/Na=-2,713 V, Ni²⁺/Ni=-0,257 V, Cu²⁺/Cu=+0,340 V. Ở điều kiện chuẩn, kim loại không khử được ion H⁺ thành H₂ là
Câu 8: Thí nghiệm nào sau đây có xảy ra phản ứng hóa học? (E° Sn²⁺/Sn=-0,137 V; E° Cu²⁺/Cu=+0,340 V; E° Fe²⁺/Fe=-0,440 V)
Câu 9: Cho thứ tự sắp xếp một số cặp oxi hoá khử: Al³⁺/Al, Fe²⁺/Fe, Sn²⁺/Sn, Cu²⁺/Cu. Kim loại nào sau đây có phản ứng với dung dịch muối tương ứng?
Câu 10: Dung dịch chất nào sau đây có thể hoà tan được Fe?
Câu 11: Ở điều kiện chuẩn, Fe khử được ion kim loại nào sau đây trong dung dịch?
Câu 12: Trong dung dịch CuSO₄, ion Cu²⁺ không bị khử bởi kim loại nào sau đây?
Câu 13: Một học sinh thực hiện ba thí nghiệm ở điều kiện chuẩn: (1) Cu không phản ứng với Pb(NO₃)₂ 1 M. (2) Pb tan trong AgNO₃ 1 M và xuất hiện tinh thể Ag. (3) Ag không phản ứng với Cu(NO₃)₂ 1 M. Trật tự nào sau đây thể hiện đúng mức độ khử của ba kim loại?
Câu 14: Cho phản ứng hoá học: Cu + 2Ag⁺ → Cu²⁺ + 2Ag. Phát biểu nào sau đây đúng?
Câu 15: Một pin Galvani cấu tạo bởi hai cặp oxi hoá – khử: Ag⁺ + e → Ag (E°=+0,799 V) và Ni²⁺ + 2e → Ni (E°=-0,257 V). Khi pin làm việc ở điều kiện chuẩn, nhận định nào đúng?
Câu 16: Dự đoán hiện tượng xảy ra khi dùng thìa Cu khuấy dung dịch Al(NO₃)₃?
Câu 17: Nhúng thanh Al và Cu vào dung dịch H₂SO₄ 1M. Nối hai thanh với nhau bằng dây dẫn. Phát biểu không đúng là:
Câu 18: Theo quy ước, kí hiệu pin điện hoá với điện cực âm đặt bên trái, điện cực dương đặt bên phải. Thông tin phù hợp điền vào là:
Câu 19: Trong pin điện hoá, quá trình khử xảy ra ở:
Câu 20: Trong pin Zn–Cu, phản ứng hoá học xảy ra giữa hai dạng nào của các cặp oxi hoá – khử?
Câu 21: Trong quá trình hoạt động của pin Zn–Cu, dòng electron di chuyển từ:
Câu 22: Pin điện hoá: Zn(s) + Cu²⁺(aq) → Cu(s) + Zn²⁺(aq). Kí hiệu pin điện hoá là:
Câu 23: Trong pin Galvani, thành phần không bắt buộc có trong pin là:
Câu 24: Trong pin Zn–Cu, nhận định không đúng về vai trò của cầu muối là:
Câu 25: Sức điện động chuẩn của pin Galvani được tính bằng:
Câu 26: Khi pin Zn–Cu hoạt động, nồng độ ion:
Câu 27: Trong pin Zn–Ag, hiện tượng quan sát được:
Câu 28: Pin quả chanh được thiết lập gồm một dây Cu và dây Zn ghim vào một quả chanh và nối với bóng điện như hình dưới:


Câu 29: Một pin Galvani có cấu tạo như sau:
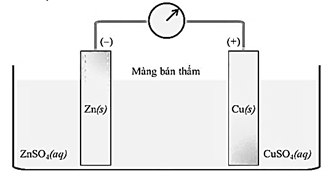
Trong đó, màng bán thấm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan là 1,00M. Cho biết: E°(Zn²⁺/Zn)=-0,763 V; E°(Cu²⁺/Cu)=+0,340 V. Phát biểu nào sau đây là sai?

Trong đó, màng bán thấm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các dung dịch đều là 0,50 L và nồng độ chất tan là 1,00M. Cho biết: E°(Zn²⁺/Zn)=-0,763 V; E°(Cu²⁺/Cu)=+0,340 V. Phát biểu nào sau đây là sai?
Câu 30: Trong điện phân, các ion âm (anion) di chuyển về:
Câu 31: So sánh pin điện và bình điện phân, phát biểu đúng là:
Câu 32: Khi điện phân NaCl nóng chảy (điện cực trơ), ở cathode xảy ra:
Câu 33: Điện phân NaOH nóng chảy, quá trình tại anode là:
Câu 34: Điện phân dung dịch CuSO₄, ion điện phân đầu tiên ở cathode là:
Câu 35: Điện phân dung dịch CuSO₄ (điện cực trơ), tại anode xảy ra:
Câu 36: Điện phân dung dịch CuSO₄ với anode graphite, tại cathode xảy ra:
Câu 37: Điện phân dung dịch NaCl 20% với điện cực trơ, màng ngăn xốp. Quá trình khử xảy ra ở cathode là:
Câu 38: Điện phân AgNO₃ với anode trơ và cathode thép. Quá trình xảy ra ở cathode giai đoạn đầu là:
Câu 39: Điện phân dung dịch Cu(NO₃)₂ 0,1 M + AgNO₃ 0,1 M, quá trình khử đầu tiên ở cathode là:
Câu 40: Điện phân dung dịch NaCl + HCl (điện cực trơ, có màng ngăn). Giá trị pH dung dịch thu được so với dung dịch ban đầu