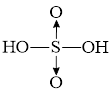Sulfur Và Hợp Chất Của Sulfur
Ôn tập kiến thức về sulfur và hợp chất của sulfur
Câu 1: Cấu hình electron của nguyên tố sulfur (Z = 16) là
Câu 2: Nguyên tố sulfur có Z = 16. Công thức oxide cao nhất của sulfur là
Câu 3: Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
Câu 4: Tính chất nào sau đây không phải là tính chất vật lí của sulfur?
Câu 5: Sulfur nóng chảy ở nhiệt độ nào sau đây?
Câu 6: Sulfur có các mức oxi hóa là
Câu 7: Số oxi hóa của sulfur trong một loại hợp chất oleum H₂S₂O₇ là
Câu 8: Đơn chất vừa có tính oxi hóa vừa có tính khử là
Câu 9: Phát biểu nào sau đây đúng khi nói về tính chất hoá học của sulfur?
Câu 10: Kim loại nào sau đây tác dụng với sulfur ở nhiệt độ thường?
Câu 11: Sulfur thể hiện tính oxi hóa khi tác dụng với chất nào dưới đây:
Câu 12: Cho một ít bột sulfur vào ống nghiệm chứa dung dịch HNO₃ đặc đun nhẹ. Hiện tượng thu được là?
Câu 13: Số oxi hoá của sulfur trong phân tử SO₂ là bao nhiêu?
Câu 14: Ở điều kiện thường, sulfur dioxide (SO₂) là
Câu 15: Ở 20°C, 1 lít nước có thể hoà tan được bao nhiêu lít khí sulfur dioxide?
Câu 16: Để làm khô khí SO₂ có lẫn hơi nước, người ta dùng:
Câu 17: Chất khí X tan trong nước tạo ra một dung dịch làm chuyển màu quỳ tím thành đỏ rồi mất màu và có thể được dùng làm chất tẩy màu. Khí X là
Câu 18: Mưa acid ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp. Tác nhân chủ yếu trong khí thải gây ra mưa acid là
Câu 19: Phản ứng sản xuất SO₂ trong công nghiệp là
Câu 20: Sulfur trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
Câu 21: Khí SO₂ là chất
Câu 22: Để điều chế Sulfuric acid, người ta có thể cho chất nào sau đây tác dụng với nước?
Câu 23: Sục một khí vào nước bromine, thấy nước bromine bị nhạt màu. Khí đó là
Câu 24: Khí nào sau đây làm mất màu cánh hoa hồng?
Câu 25: Để phân biệt CO₂ và SO₂ chỉ cần dùng thuốc thử là
Câu 26: Để loại bỏ SO₂ ra khỏi CO₂, có thể dùng cách nào sau đây?
Câu 27: Để phân biệt hai khí SO₂ và SO₃ có thể dùng
Câu 28: Để phân biệt ba bình mất nhãn đựng riêng biệt các khí CO₂, SO₂ và N₂, một học sinh đã dự định dùng thuốc thử(một cách trật tự) theo 4 cách dưới đây. Cách nào đúng?
Câu 29: Để tách SO₂ khỏi hỗn hợp SO₂, N₂, O₂ ta dùng hoá chất là
Câu 30: Khi sục SO₂ vào dung dịch H₂S thì
Câu 31: Cho phản ứng: SO₂ + Cl₂ + 2H₂O → 2HCl + H₂SO₄. Vai trò của sulfur dioxide là
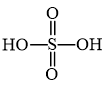
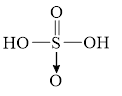
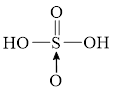
Câu 32: Phân tử sulfuric acid (H₂SO₄) có công thức cấu tạo nào sau đây?
Câu 33: Cho hình vẽ sau:
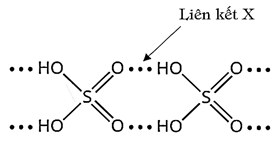
Liên kết X thuộc loại liên kết nào sau đây?

Liên kết X thuộc loại liên kết nào sau đây?
Câu 34: Để pha loãng H₂SO₄ đặc cách làm nào sau đây đúng?
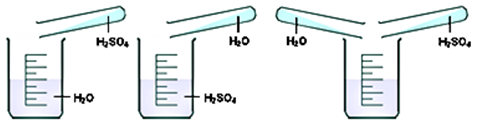
Cách 1 Cách 2 Cách 3

Cách 1 Cách 2 Cách 3
Câu 35: Acid H₂SO₄ loãng tác dụng với Fe tạo thành sản phẩm
Câu 36: Dung dịch sulfuric acid loãng tác dụng được với 2 chất trong dãy nào sau đây?
Câu 37: Sulfuric acid đặc không được dùng để làm khô khí nào sau đây?
Câu 38: Khí sau đây có thể được làm khô bằng H₂SO₄ đặc?
Câu 39: Sulfuric acid đặc được sử dụng làm khô các chất khí ẩm. Khí nào sau đây không thể làm khô bằng H₂SO₄ đặc?
Câu 40: Chất dùng để làm khô khí Cl₂ ẩm là
Câu 41: Các khí sinh ra trong thí nghiệm phản ứng của saccharose (C₁₂H₂₂O₁₁) với dung dịch H₂SO₄ đặc bao gồm:
Câu 42: Nhỏ dung dịch H₂SO₄ 98% vào cốc đựng đường saccharose thì sẽ có hiện tượng gì?
Câu 43: Chọn phát biểu đúng
Câu 44: Phát biểu đúng là
Câu 45: Nhóm gồm tất cả các kim loại tan trong dung dịch H₂SO₄ đặc nóng nhưng không tan trong dung dịch H₂SO₄ loãng là
Câu 46: Để phân biệt 4 chất lỏng: HCl, H₂SO₄, Na₂SO₄, NaCl. Ta có thể dùng lần lượt các chất:
Câu 47: Có 4 dung dịch là: NaOH, H₂SO₄, HCl, Na₂CO₃. Chỉ được dùng thêm một dung dịch thuốc thử nào sau đây để phân biệt được các dung dịch trên?
Câu 48: Để nhận biết 4 dung dịch đựng trong 4 lọ mất nhãn là KOH, NH₄Cl, K₂SO₄, (NH₄)₂SO₄, ta có thể chỉ dùng một thuốc thử nào trong số các thuốc thử sau: