TN1. Thí nghiệm ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng hóa học.
- Quan sát hiện tượng thực tế về sự thay đổi màu của hỗn hợp khí NO₂/N₂O₄ khi thay đổi nhiệt độ.
- Giải thích hiện tượng theo nguyên lý Lơ Sa-tơ-li-ê (Le Chatelier).
- Củng cố hiểu biết về bản chất động của cân bằng hóa học và yếu tố ảnh hưởng đến cân bằng.
1/ TÊN THÍ NGHIỆM: Ảnh hưởng của nhiệt độ đến cân bằng:
2/ CHUẨN BỊ
- Hoá chất: Khí nitrogen dioxide (NO₂), nước đá, nitric acid đặc (HNO₃), copper (Cu).
- Dụng cụ: Hai ống nghiệm thông nhau có khóa, chậu thủy tinh, bình cầu đáy bằng, nút cao su có kèm ống hút nhỏ giọt, cốc thủy tinh, bình cầu đáy bằng cỡ nhỏ.
3/ CÁC BƯỚC TIẾN HÀNH
Chuẩn bị 3 ống nghiệm (1), (2), (3) chứa khí NO₂ (có màu giống nhau), 1 cốc nước đá, 1 cốc nước nóng (70 – 80°C).
- Ống nghiệm 1: Dùng để so sánh.
- Ống nghiệm 2: Ngâm vào cốc nước đá khoảng 1 – 2 phút.
- Ống nghiệm 3: Ngâm vào cốc nước nóng khoảng 1 – 2 phút
4/ LINK VIDEO THÍ NGHIỆM
5/ PHÂN TÍCH Ý NGHĨA TỪNG BƯỚC TIẾN HÀNH
| Bước tiến hành | Mục đích / Ý nghĩa | Phương trình / Giải thích |
|---|---|---|
Chuẩn bị 3 bình khí NO₂ có màu giống nhau, đóng kín. | Bảo đảm cùng trạng thái ban đầu và hệ kín để so sánh kết quả. |
|
Bình 1 – đối chứng (nhiệt độ phòng). | Làm mốc so sánh để quan sát sự thay đổi khi thay đổi nhiệt độ. | Ở nhiệt độ phòng, màu nâu trung bình do cân bằng giữa NO₂ và N₂O₄. |
Bình 2 – ngâm nước đá. | – Thử ảnh hưởng giảm nhiệt độ. |
|
Bình 3 – ngâm nước nóng. | – Thử ảnh hưởng tăng nhiệt độ. |
|
Dùng nước (đá/nóng) làm thay đổi nhiệt. | Tạo môi trường nhiệt độ ổn định, truyền nhiệt đều, an toàn. | Tránh gia nhiệt trực tiếp gây tăng áp cục bộ hoặc nguy hiểm. |
6/ NHẬN XÉT VÀ GIẢI THÍCH HIỆN TƯỢNG
-
Ống nghiệm 1 (Đối chứng): Giữ nguyên màu nâu đỏ ban đầu (màu chuẩn).
-
Ống nghiệm 2 (Trong nước đá): Màu nâu đỏ nhạt dần, có thể trở nên gần như không màu.
-
Ống nghiệm 3 (Trong nước nóng): Màu nâu đỏ đậm lên (sẫm màu hơn).
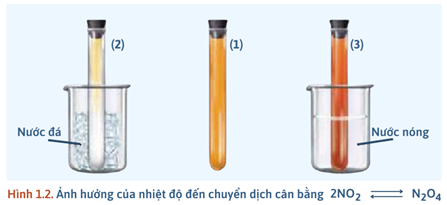
Giải thích Hiện tượng này được giải thích hoàn toàn bằng Nguyên lí chuyển dịch cân bằng Le Chatelier.
- Nguyên lí Le Chatelier: Một hệ cân bằng đang ổn định, khi chịu tác động từ bên ngoài (thay đổi nồng độ, áp suất, hoặc nhiệt độ), sẽ tự chuyển dịch theo chiều làm giảm thiểu tác động đó.
- Áp dụng cho phản ứng trên: Hệ
- Giảm nhiệt độ → Cân bằng phải chuyển dịch theo chiều sinh ra nhiệt (tức là chiều tỏa nhiệt) → tạo N₂O₄ (màu nhạt).
- Tăng nhiệt độ → Cân bằng phải chuyển dịch theo chiều hấp thụ nhiệt (tức là chiều thu nhiệt) phân li N₂O₄ → tăng NO₂ (màu đậm).