TN3. Chuẩn độ acid – base
Xác định nồng độ dung dịch NaOH chưa biết bằng chuẩn độ với HCl 0,100 M; rèn kỹ năng thao tác dụng cụ đo thể tích và nhận biết điểm kết thúc với phenolphthalein.
1/ Tên thí nghiệm: Chuẩn độ base mạnh bằng dung dịch chuẩn acid mạnh
2/ Chuẩn Bị
- Dung dịch HCl 0,1M; dung dịch NaOH chưa biết nồng độ (khoảng 0,1M); dung dịch phenolphthalein.
- Pipette 10 mL; Burette 25 mL; bình tam giác 100 mL; bình tia nước cất; giá đỡ; kẹp burete.
3/ Các bước tiến hành
- Bước 1: Lắp dụng cụ như hình bên dưới, xoay vạch đọc thể tích về phía mắt.
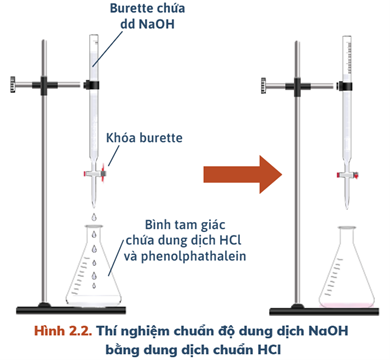
– Tráng sạch burette bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH.
– Cho dung dịch NaOH vào cốc thủy tinh, sau đó rót vào burette (đã khóa) và chỉnh về vạch 0.
- Bước 2: Dùng pipette lấy dung dịch HCl 0,1M cho vào ba bình tam giác, mỗi bình 10,00 mL. Dùng ống hút nhỏ giọt để lấy chất chỉ thị, nhỏ 1 – 2 giọt phenolphthalein vào các bình tam giác.
- Bước 3: Vặn khóa burette để dung dịch NaOH trong burette chảy từ từ vào bình tam giác. Quan sát đến khi dung dịch trong bình xuất hiện màu hồng nhạt bền trong khoảng 10 giây hoặc 20 giây hoặc 30 giây thì dừng lại.
- Bước 4: Đọc thể tích dung dịch NaOH trên vạch của burette.
- Bước 5: Lặp lại ít nhất 3 lần. Lấy giá trị trung bình của 3 lần chuẩn độ
4/ Link video thí nghiệm
5/ Phân tích ý nghĩa từng bước tiến hành
| Bước tiến hành | Mục đích / Ý nghĩa | Phương trình / Giải thích |
|---|---|---|
Lắp burette trên giá, chỉnh vạch đọc ngang tầm mắt; tráng burette bằng nước cất rồi tráng lại bằng một ít dung dịch NaOH; nạp NaOH vào burette và chỉnh về gần vạch 0,00 mL. | Loại tạp nhiễm, làm ướt thành trong; tráng bằng dung dịch giúp tránh pha loãng NaOH bởi nước còn đọng. Đặt mắt ngang mặt khum (mặt cong) để tránh sai số khi đọc thể tích. | Không có phản ứng; nguyên tắc đo thể tích chính xác và giảm sai số hệ thống. |
Dùng pipette lấy 10,00 mL HCl 0,100 M vào ba bình tam giác; nhỏ 1–2 giọt phenolphthalein. | Bảo đảm thể tích mẫu chính xác và đồng nhất giữa các lần; chỉ thị giúp nhận biết điểm kết thúc khi vừa xuất hiện màu hồng nhạt bền (10–30 giây). | Ở đầu chuẩn độ, dung dịch trong bình không màu do môi trường acid. |
Mở khóa cho NaOH chảy từ từ, xoay đều bình; đến khi màu hồng nhạt xuất hiện và bền khoảng 10–30 giây thì dừng. | Tiệm cận điểm tương đương; tốc độ chảy chậm giúp vượt điểm kết thúc ít nhất (tránh quá điểm). Trộn đều để phản ứng hoàn toàn sau mỗi thể tích nhỏ. |
|
Đọc thể tích NaOH đã dùng trên burette . | Ghi số liệu chính xác đến 0,05 mL (hoặc 0,02 mL tùy vạch). Mọi đọc số đều ở mặt khum (mặt cong) dưới. | Không có phản ứng; dữ liệu phục vụ tính toán nồng độ. |
Lặp lại tối thiểu 3 lần với mẫu HCl mới; loại trừ số liệu ngoại lai, lấy giá trị trung bình V̄. | Tăng độ tin cậy; đánh giá độ lặp lại (RSD%). | Không có phản ứng; nguyên tắc xử lý số liệu thực nghiệm. |
6/ Nhận xét và giải thích hiện tượng
- Dung dịch trong bình ban đầu không màu (môi trường acid).
- Khi gần điểm kết thúc, màu hồng thoáng xuất hiện rồi mất khi lắc (do OH⁻ vừa thêm bị trung hòa ngay).
- Tại điểm kết thúc, xuất hiện màu hồng nhạt bền 10–30 giây: pH xấp xỉ ngưỡng đổi màu của phenolphthalein; lượng OH⁻ vừa đủ tạo môi trường hơi kiềm.
- Nếu quá điểm: dung dịch chuyển hồng đậm và bền; thể tích NaOH bị “thừa”, gây sai số dương cho nồng độ tính được.
★ Cách tính toán nồng độ dung dịch chuẩn độ
Ta có: tại điểm tương đương:
7/ Câu hỏi củng cố và mở rộng
8/ MỘT SỐ LƯU Ý
Sai số thường gặp:
- Không tráng burette bằng dung dịch chuẩn → pha loãng;
- Đọc meniscus sai (thị sai);
- Chảy quá nhanh gần điểm kết thúc;
- Dung dịch NaOH hấp thụ CO₂ không khí → tạo Na₂CO₃ làm giảm “chuẩn độ hiệu dụng”.
Kiểm soát: che miệng bình khi chờ; chuẩn hóa NaOH nếu cần; ghi ngay số liệu; lặp lại ≥3 lần.
An toàn: HCl/NaOH ăn mòn; đeo kính–găng; rửa ngay nếu bắn vào da; xử lý chất thải theo quy định.