TN6. Phản ứng của dung dịch H₂SO₄ đặc, nóng với kim loại đồng
Quan sát được hiện tượng Cu bị oxi hóa, H₂SO₄ đặc bị khử; giải thích bản chất phản ứng oxi hóa–khử; nhận biết khí SO₂ và hiện tượng đổi màu cánh hoa; liên hệ tính oxi hóa của các acid mạnh khác.
1/ TÊN THÍ NGHIỆM: Phản ứng của dung dịch H₂SO₄ đặc, nóng với kim loại đồng
2/ CHUẨN BỊ
- Hóa chất: Sulfuric acid đặc (H2SO4), kim loại Cu (copper), dung dịch sodium hydroxide 1M (NaOH), cánh hoa hồng. Bông gòn.
- Dụng cụ: Ống nghiệm 2 nhánh, nút cao su, đèn cồn. Ống nhỏ giọt.
3/ CÁC BƯỚC TIẾN HÀNH
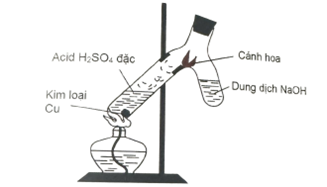
- Ống nghiệm 2 nhánh:
Nhánh 1: cho 2 mL dung dịch H2SO4 đặc và một mảnh kim loại Cu.
Nhánh 2: Cho 4 ml dung dịch NaOH 1M. - Cho một cánh hoa áp vào mặt trong của eo ống nghiệm. Đun nóng.
4/ LINK VIDEO THÍ NGHIỆM
5/ PHÂN TÍCH Ý NGHĨA TỪNG BƯỚC TIẾN HÀNH
| Bước tiến hành | Mục đích / Ý nghĩa | Phương trình / Giải thích |
|---|---|---|
Cho 2 mL H₂SO₄ đặc và một mảnh Cu vào nhánh 1 của ống nghiệm hai nhánh. | Tạo hệ phản ứng giữa kim loại và acid sunfuric đặc; đồng thời cách ly với nhánh 2 để dẫn khí sinh ra. | Khi đun nóng, Cu bị H₂SO₄ đặc oxi hóa, sinh khí SO₂. |
Cho 4 mL dung dịch NaOH 1M vào nhánh 2. | Dung dịch NaOH hấp thụ khí SO₂ tạo Na₂SO₃/NaHSO₃ – giúp nhận biết và tránh phát tán khí độc. |
|
Áp cánh hoa vào eo ống nghiệm nối giữa hai nhánh. | Cánh hoa hồng chứa anthocyanin (chỉ thị tự nhiên), nhạy với môi trường acid. Khi khí SO₂ đi qua, cánh hoa đổi màu. | SO₂ hòa tan trong nước tạo H₂SO₃, có môi trường acid yếu anthocyanin chuyển đỏ nhạt hoặc nâu vàng. |
Đun nóng nhẹ nhánh chứa H₂SO₄ đặc và kim loại Cu. | Kích thích phản ứng oxi hóa–khử xảy ra, tạo khí SO₂; phản ứng chỉ xảy ra mạnh khi H₂SO₄ đặc, nóng. | H₂SO₄ đặc vừa là acid, vừa là chất oxi hóa mạnh. |
6/ NHẬN XÉT VÀ GIẢI THÍCH HIỆN TƯỢNG
Hiện tượng quan sát được:
- Kim loại copper (Cu) dần tan, dung dịch có màu xanh lam.
- Khí SO₂ thoát ra có mùi hắc.
- Cánh hoa hồng đổi màu nâu vàng hoặc đỏ nhạt.
- Dung dịch NaOH ở nhánh 2 có bọt khí, có thể hơi đục.
Giải thích:
- H₂SO₄ đặc, nóng là chất oxi hóa mạnh, có thể oxi hóa được hầu hết các kim loại ( trừ Au và Pt), tạo ra sản phẩm khử là H2S, SO2, S ( tùy từng trường hợp).
- Trong thí nghiệm trên, Cu bị oxi hóa thành Cu²⁺, còn S⁶⁺ trong H₂SO₄ bị khử thành S⁴⁺ (SO₂). Phản ứng oxi hóa–khử:
Dung dịch xanh là màu của muối CuSO₄, khí SO₂ tạo môi trường acid làm đổi màu cánh hoa.