TN13. Phản ứng oxi hóa của ethylen (C₂H₄ + KMnO₄)
Quan sát hiện tượng mất màu dung dịch KMnO₄ khi cho C₂H₄ tác dụng; nhận biết phản ứng oxi hóa đặc trưng của nối đôi C=C; phân biệt phản ứng cộng (với Br₂) và phản ứng oxi hóa (với KMnO₄); giải thích bản chất và ứng dụng thực tế của phản ứng này.
1/ TÊN THÍ NGHIỆM: Phản ứng oxi hóa của etylen (C₂H₄) với dung dịch KMnO₄.
2/ CHUẨN BỊ
- Dụng cụ: bình cầu, ống nghiệm có nhánh, ống nghiệm, ống thủy tinh chữ L, ống thủy tinh vuốt nhọn, ống hút nhỏ giọt, đèn cồn, đá bọt hoặc cát sạch, ống dẫn khí cao su, nút cao su, giá đỡ ống nghiệm.
- Hóa chất: Ethanol 90° (cồn 90°), dung dịch H₂SO₄ đậm đặc, dung dịch NaOH đặc, dung dịch KMnO₄ 0,01 M.
3/ CÁC BƯỚC TIẾN HÀNH
- Bước 1: Cho vào bình cầu khoảng 10 mL cồn 90°, thêm tiếp khoảng 15 mL dung dịch H₂SO₄ đậm đặc và một ít đá bọt, lắc đều.
- Bước 2: Chuẩn bị 2 ống nghiệm, cho khoảng 5 mL dung dịch NaOH đặc vào ống (1) và khoảng 2 mL dung dịch KMnO₄ 0,01 M vào ống nghiệm còn lại.
- Bước 3: Lắp dụng cụ như hình thí nghiệm ethylene với nước Br₂ ở trên. Dùng đèn cồn đun nóng đều bình cầu. Quan sát màu của dung dịch KMnO₄ trong quá trình thí nghiệm.
4/ LINK VIDEO THÍ NGHIỆM
(Chưa có — sẽ bổ sung sau)
5/ PHÂN TÍCH Ý NGHĨA TỪNG BƯỚC TIẾN HÀNH
| Bước tiến hành | Mục đích / Ý nghĩa | Phương trình / Giải thích |
|---|---|---|
Cho 10 mL etanol và 15 mL H₂SO₄ đậm đặc cùng đá bọt vào bình cầu, lắc đều. | H₂SO₄ đặc vừa là chất xúc tác tách nước, vừa hút ẩm; đá bọt giúp sôi đều, tránh sôi vọt. | |
Chuẩn bị 2 ống nghiệm: (1) chứa NaOH đặc, (2) chứa dung dịch KMnO₄ 0,01 M. | NaOH đặc hấp thụ khí phụ (SO₂); dung dịch KMnO₄ dùng để thử tính oxi hóa của C₂H₄. | Không có phản ứng trong bước này. |
| Lắp dụng cụ kín, đun nóng bình cầu bằng đèn cồn. | Sinh khí C₂H₄, dẫn khí qua dung dịch KMnO₄ để quan sát hiện tượng. | |
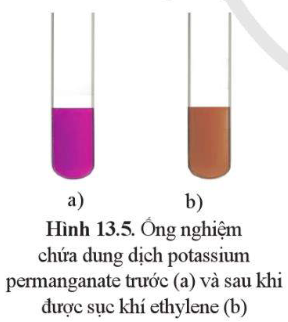
| Quan sát màu dung dịch KMnO₄ trong quá trình thí nghiệm. | Nhận biết phản ứng oxi hóa của C₂H₄; dung dịch KMnO₄ bị khử, mất màu tím, xuất hiện kết tủa nâu. |
6/ NHẬN XÉT VÀ GIẢI THÍCH HIỆN TƯỢNG
Hiện tượng quan sát được:
- Dung dịch KMnO₄ mất màu tím và xuất hiện kết tủa nâu MnO₂.
- Bình sinh khí có bọt khí không màu (C₂H₄).
- Nếu dẫn khí lâu, kết tủa nâu lắng dần xuống đáy ống nghiệm.
Giải thích bản chất:
- C₂H₄ có liên kết đôi C=C dễ bị oxi hóa nhẹ bởi KMnO₄.
- KMnO₄ là chất oxi hóa mạnh, bị khử từ Mn⁷⁺ → Mn⁴⁺ (MnO₂).
- C₂H₄ bị oxi hóa thành etylen glicol (C₂H₄(OH)₂).
- Phản ứng đặc trưng của anken dùng để nhận biết sự có mặt của nối đôi.
Phân biệt với phản ứng cộng Br₂:
- Với Br₂: phản ứng cộng, dung dịch mất màu, không có kết tủa.
- Với KMnO₄: phản ứng oxi hóa, dung dịch mất màu và có kết tủa nâu MnO₂.
7/ CÂU HỎI ÔN TẬP
8/ KẾT LUẬN
Thí nghiệm minh họa rõ tính oxi hóa đặc trưng của nối đôi C=C trong anken.
Phản ứng với KMnO₄ giúp nhận biết nhanh sự có mặt của liên kết đôi và phân biệt anken với ankan.
Qua đó, học sinh hiểu rõ bản chất phản ứng oxi hóa nhẹ và củng cố ý thức an toàn khi thao tác với hóa chất mạnh như H₂SO₄ và KMnO₄.