TN2. Thí nghiệm ảnh hưởng của nồng độ đến cân bằng hóa học.
Nghiên cứu sự thay đổi nồng độ chất phản ứng hoặc nồng độ chất sản phẩm ảnh hưởng đến trạng thái cân bằng hóa học.
1/ TÊN THÍ NGHIỆM: Ảnh hưởng của nồng độ đến cân bằng:
2/ CHUẨN BỊ
- Hóa chất: CH₃COONa dạng tinh thể và dung dịch, phenolphtalein. Dung dịch CH₃COOH.
- Dụng cụ: ống nghiệm (hoặc cốc thủy tinh), ống nhỏ giọt.
3/ CÁC BƯỚC TIẾN HÀNH
-
Cho một vài giọt phenolphthalein vào dung dịch CH₃COONa, lắc đều, dung dịch có màu hồng nhạt.
-
Chia dung dịch thu được vào ba ống nghiệm với thể tích gần bằng nhau.
-
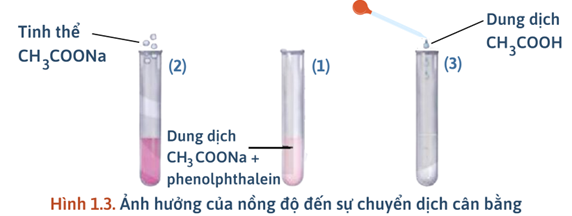
Ống (1) để so sánh; ống (2) thêm vài tinh thể CH₃COONa; ống 3 thêm một vài giọt dung dịch CH₃COOH.
4/ LINK VIDEO THÍ NGHIỆM
5/ PHÂN TÍCH Ý NGHĨA TỪNG BƯỚC TIẾN HÀNH
| Bước tiến hành | Mục đích / Ý nghĩa | Phương trình / Giải thích |
|---|---|---|
Nhỏ phenolphthalein vào dung dịch CH₃COONa. |
| CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻. |
Chia đều dung dịch vào 3 ống nghiệm. | Bảo đảm điều kiện ban đầu giống nhau để so sánh khi thêm các chất khác nhau. | Các hệ tương đương trước khi tác động các yếu tố bên ngoài. |
Ống (1) – đối chứng. | Làm mốc màu chuẩn để so sánh; không thay đổi nồng độ. | Không có thay đổi đáng kể trong cân bằng. |
Ống (2): thêm tinh thể CH₃COONa. | Tăng [CH₃COO⁻] (ion chung) → pH tăng nhẹ → màu hồng đậm hơn. | CH₃COO⁻ + H₂O ⇌ CH₃COOH + OH⁻; tăng chất phản ứng làm tăng [OH⁻]. |
Ống (3): thêm vài giọt CH₃COOH. | Tăng [H⁺]/[CH₃COOH] → trung hòa OH⁻ → pH giảm → màu nhạt hoặc mất màu. | CH₃COO⁻ + H⁺ → CH₃COOH; |
6/ NHẬN XÉT VÀ GIẢI THÍCH HIỆN TƯỢNG
Phương trình: CH₃COONa + H₂O ⇌ CH₃COOH + NaOH
- Ống (1): đối chứng → màu hồng nhạt ổn định.
- Ống (2): Tăng nồng độ CH₃COONa thấy màu sắc đậm lên. Do cân bằng chuyển dịch theo chiều làm giảm CH₃COONa (chiều thuận) → NaOH tạo ra nhiều hơn (NaOH làm phenolphthalein từ không màu chuyển sang màu hồng)
- Ống (3): Tăng nồng độ CH₃COOH ta thấy màu sắc nhạt đi, do cân bằng chuyển dịch theo chiều làm giảm CH₃COOH (chiều nghịch) → làm giảm lượng NaOH (môi trường base giảm nên phenolphthalein chuyển sang màu hồng nhạt hơn)